
- 栏目分类
- 开云体育官网登录入口网址介绍
- 产品展示
- 新闻动态
一篇文章让你了解现在抗癌最热门的药物--抗体偶连药物(ADC), 应用不再茫然。
今天我们介绍了抗体偶联药物(ADC),包括图1 和 2。在这些治疗中,抗体被用作递送工具,将化疗药物直接运输到患者的癌细胞。
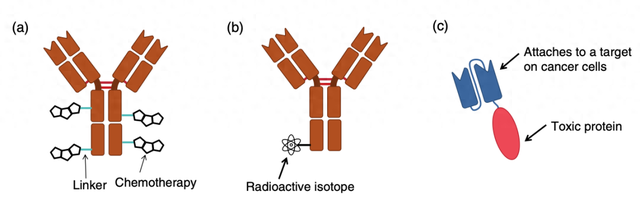
图1 偶联抗体可以递送化疗药物、放射性物质或毒素。(a) 抗体 - 药物偶联物由抗体、连接子和一种或多种化疗药物分子组成。两种常用的化疗药物是卡奇霉素和奥瑞他汀。(b) 抗体可用于将放射性同位素递送至癌细胞。(c) “免疫毒素” 由抗体的尖端(Fv 部分)与有毒蛋白质(如来自铜绿假单胞菌的外毒素 A)的细胞杀伤部分连接而成。
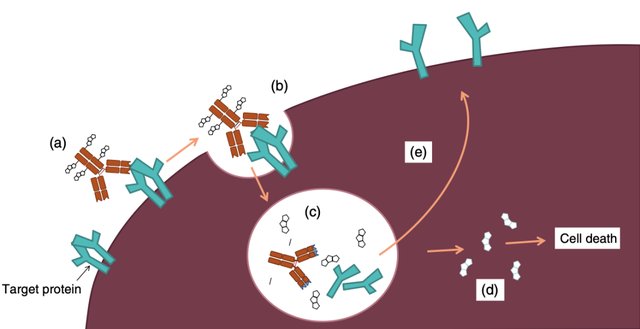
图2 抗体 - 药物偶联物(ADCs)的作用机制。(a) 一个 ADC 附着在细胞表面的靶蛋白上。(b) 细胞膜向内折叠形成一个包含 ADC 的隔室(内体)。(c) ADC 的连接子断裂,释放出有毒的化疗药物。(d) 化疗药物释放到细胞质中,通过破坏微管或导致 DNA 断裂来杀死细胞。(e) 抗体的靶蛋白可能被破坏或循环回到细胞表面。
在深入探讨更多细节之前,关于 ADC 有几点需要牢记:
除了递送化疗药物外,抗体还可能触发涉及巨噬细胞、自然杀伤(NK)细胞和补体蛋白的免疫反应。
根据抗体的靶点不同,ADC 可能无需释放化疗药物即可杀死部分癌细胞(例如,所有靶向 HER2 的抗体对HER2阳性癌细胞都具有潜在杀伤力)。
除非抗体的靶点仅存在于患者的癌细胞上,否则它会导致健康细胞的一定破坏。
只有极小部分ADC药物能进入患者的癌细胞。因此,患者可能会经历由化疗有效载荷引起的毒性。
在介绍下面内容之前,先在表1显示目前已在国外临床获批的药物:
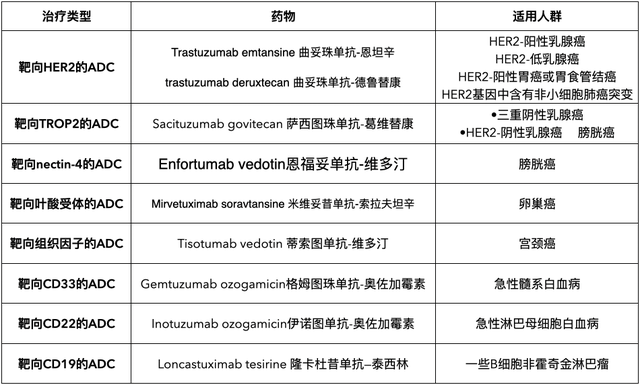
表1
1 .ADC 的结构
ADC 主要由三个部分组成:抗体、药物和连接子(表2)。
表2
要素
描述
抗体
通常是一种人源化或完全人源的抗体,以降低免疫原性并减少输注反应。针对在患者癌细胞上发现的一种细胞表面蛋白。科学家们希望找到抗体对其靶点的最佳亲和力水平:亲和力过低,抗体就无法附着在癌细胞上;亲和力过高,抗体就会附着在血管附近的癌细胞上,而无法深入肿瘤内部。连接子
可裂解连接子(对pH 敏感、可被蛋白酶裂解或对谷胱甘肽浓度敏感)在癌细胞内断裂(裂解)。不可裂解连接子需要蛋白酶体降解才能释放化疗药物(即只有当ADC 在细胞内完全分解时,药物才会释放)。药物
由于目标细胞内达到的浓度相对较低,因此需要高效。常见的选择是拓扑异构酶抑制剂(Dxd和SN-38)、微管抑制剂(美坦苷或奥里他汀)和DNA破坏剂(主要是卡利霉素)。•选择的药物通常太强效(因此太有毒),除非它构成ADC的一部分,否则不能给患者服用。
•在毒性和效力之间找到平衡很重要:太强,会对患者造成副作用;效力不够强,无法杀死癌细胞。
近年来,药物选择的重点发生了转变。较新的ADC通常包含拓扑异构酶抑制剂,如 Dxd(ADC名称以 deruxtecan结尾)或 SN-38(ADC名称以 govitecan 结尾)。拓扑异构酶抑制剂的效力比美坦辛类或卡利奇霉素弱,因此其设计目的是减轻副作用。起初,它们的效力不足被视为一个问题,但通过增加每个抗体连接的化疗药物拷贝数,这一问题已得到解决。
2 如何改进 ADC
近年来,科学家们逐步改进了所研发 ADC 的特性(总结见图3)。
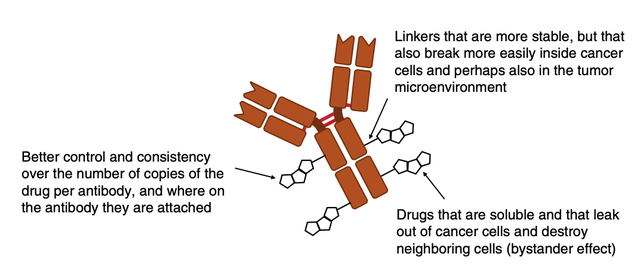
图3
示例:曲妥珠单抗德鲁替康
曲妥珠单抗恩坦辛与较新的ADC曲妥珠单抗德鲁替康之间的比较说明了这一进展(表3)。从名称可以看出,这两种ADC都是曲妥珠单抗的改良版本,曲妥珠单抗是一种HER2靶向抗体,于1998年首次获批用于治疗 HER2阳性乳腺癌。
表3 曲妥珠单抗恩坦辛与曲妥珠单抗德鲁替康的特性比较
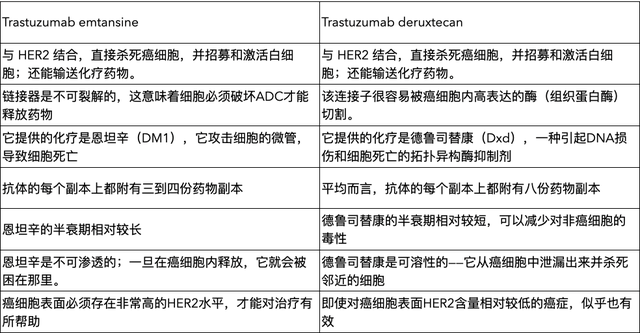
曲妥珠单抗德鲁替康具有多种改进特性,这似乎是其在 DESTINY-Breast03 等研究中表现优于曲妥珠单抗恩坦辛的原因。
3. ADC 的常见靶点及治疗示例
ADC 的靶点不需要是细胞赖以生存的物质(不过如果是的话可能会有帮助)。其设计理念是抗体携带的药物将负责杀死任何被递送到的细胞。然而,靶点确实需要存在于患者癌细胞的表面,并且希望在健康细胞上不存在或仅少量存在。
随着获批作为癌症治疗药物的 ADC 数量增加,靶点的数量也在增加。我在表4中列出了一些最常见的靶点。
从临床试验中大量的 ADC 来看,毫无疑问,未来几年这些药物和靶点的列表将会更长。
表4 抗体-药物共轭物的当前和新兴靶点。截至2024年3月,橙色突出显示的抗体是一种或多种癌症的批准治疗方法。
表4
靶点
治疗例子
建议
HER2
曲妥珠单抗-恩坦辛曲妥珠单抗-德鲁替康曲妥珠单抗-多卡马嗪迪西他单抗-维多汀抗体药物偶联物(ADCs)是人类表皮生长因子受体2(HER2)阳性乳腺癌和胃/ 胃食管交界癌的既定治疗方法。德曲妥珠单抗也被批准用于“HER2 低表达” 乳腺癌患者,在过去,这类患者缺乏足够的数据支持使用HER2 靶向治疗。对于部分其他癌症类型的个体患者,当发现其癌细胞为HER2 阳性或HER2 低表达时(例如子宫内膜癌或宫颈癌),抗体药物偶联物可能也有用。TROP2
萨西图单抗-葛维替康达托波塔单抗-德鲁替康萨西图单抗被批准用于治疗三阴性乳腺癌、HER2 阴性乳腺癌和膀胱癌。在许多上皮癌中发现TROP2 水平较高,包括乳腺癌、膀胱癌、非小细胞肺癌、小细胞肺癌以及妇科和胃肠道癌症。Nectin-4
恩福妥单抗-维多汀
被批准用于治疗膀胱癌。在一些乳腺癌、肺癌、卵巢癌和胃癌中也发现了高水平的Nectin-4。叶酸受体
Mirvetuximab soravtansine
luveltamab tazevibulin
farletuzumab ecteribulin
Mirvetuximab soravtansine 被批准用于治疗卵巢癌。间皮瘤、非小细胞肺癌和三阴性乳腺癌中也发现了FRα。组织因子
Tisotumab vedotin
被批准用于治疗宫颈癌组织因子存在于多种癌症类型中,包括胃肠道癌、泌尿生殖系统癌、神经胶质瘤、黑色素瘤和肺癌。类Delta 配体3(DLL3)
Rovalpituzumab tesirine
DLL3在小细胞肺癌被发现LIV1
Ladiratuzumab vedotin
LIV1 存在于乳腺癌及一系列其他实体瘤中,包括胃癌、胃食管结合部癌、食管癌、小细胞肺癌和非小细胞肺癌。癌胚抗原相关细胞粘附分子5(CEACAM5)
Labetuzumab govitecan
tusamitamab ravtansine
癌胚抗原相关细胞黏附分子5(CEACAM5)在多种癌症中均有发现,包括肠癌、肺癌和胃癌。4. 适用人群
我们仍处于 ADC 作为癌症治疗药物的时代初期。这意味着研究人员和制药公司仍在研究该给哪些患者使用这些治疗,以及是否应根据癌细胞上靶点蛋白的存在来选择患者。
是否使用生物标志物选择将取决于以下因素:
所治疗癌症类型的癌细胞表面靶点的存在可靠性。如果仅在小部分患者中存在,则可能需要生物标志物检测来找到他们。
ADC 的效力有多强,以及需要多少靶点才能杀死癌细胞。
试验结果如何,靶点蛋白的存在对患者获益程度的预测准确性如何 —— 如果存在密切相关性,且靶点不存在时缺乏获益,则表明实施生物标志物检测将是有用的。
举几个例子来说明:
恩沃利单抗维汀靶向 nectin-4,获批用于某些晚期膀胱癌患者,无需基于 nectin-4 水平进行患者选择。然而,患者从恩沃利单抗维汀中获得的获益程度似乎与他们癌细胞上nectin-4的量相关。nectin-4的丢失似乎也是治疗耐药的一个原因。
米尔维妥珠单抗索拉坦辛靶向叶酸受体 α(FRα),是获批用于晚期 “FRα 阳性” 卵巢癌的治疗药物。随着临床试验的进行,癌细胞上被指定为 “FRα 阳性” 所需的 FRα 水平随时间而变化。美国食品药品监督管理局(FDA)的批准基于名为SORAYA 的临床试验结果。在该试验中,“FRα 阳性” 癌症是指至少 75% 的癌细胞具有 FRα,且通过免疫组织化学检测显示染色强度为 PS2+(被认为是中等 / 强水平的 FRα)。
5. ADC 耐药的原因
ADC 耐药可能有多种原因:
癌细胞表面靶点丢失。这可能是由于靶点蛋白的基因突变或蛋白产生减少。
ADC不再能够结合其靶点。可能是由于靶点蛋白的形状改变,或某些东西掩盖了靶点,阻止ADC结合。
进入癌细胞的ADC不足。由于ADC不再被吸入癌细胞,或迅速返回表面。
释放的药物不足。也许药物被释放的速度与被排出癌细胞的速度一样快。
药物不再杀死癌细胞。癌细胞通过增加生存蛋白的量、增强 DNA 修复或对药物靶点的其他改变来保护自己免于死亡。
6. ADC 的副作用
ADC 在医学媒体中常因其改善的靶向癌细胞能力而受到赞誉,“魔法子弹” 等术语也会被提及。因此,当许多ADC在试验中未能证明有效,并且由于过度和危险的副作用而停止了许多ADC的开发,可能会让我们感到惊讶。
如果记得的话,科学家估计只有 0.1%的ADC能到达患者的癌细胞。大部分会在循环系统和其他器官及组织中逐渐分解。这意味着ADC的大部分毒性是由药物释放到体内引起的。因此,无论ADC的靶点如何,其副作用将与包含相同形式化疗的其他ADC非常相似。例如,泊洛妥珠单抗-维多汀、恩沃利单抗-维多汀和替索妥珠单抗-维多汀都会引起类似的副作用。
还值得注意的是,一般来说,具有不可裂解连接子的ADC比具有可裂解连接子的ADC引起的副作用更温和,因为血液中释放的药物较少。然而,具有可裂解连接子的ADC通常更有效并产生更好的结果。此外,高度稳定的连接子与影响眼睛的毒性有关,如结膜炎、干眼症和角膜炎症。包含单甲基 auristatin F(如替索妥珠单抗维汀)或美坦辛 DM4(如米尔维妥珠单抗索拉坦辛)的 ADC 也更可能出现眼部毒性。
这并不是说ADC不会引起 “靶向在癌,但作用在正常组织” 的毒性。例如,任何靶向HER2的治疗都可能导致心脏毒性,因为心脏细胞上有HER2。另一个例子是恩沃利单抗维汀,它靶向 nectin-4。由于 nectin-4存在于唾液腺和皮肤细胞中,它可能会改变人的味觉(称为味觉障碍)并引起皮肤问题。
7. 其他类型的偶联物
ADC 不是将药物递送到癌细胞的唯一方式。此外,抗体可能递送的不仅仅是药物。因此,还有其他策略可以将毒性物质直接递送到癌细胞,例如:
放射性标记抗体
细胞表面蛋白的放射性标记配体
药物偶联小分子
药物偶联肽
免疫毒素
7.1 放射性标记配体、肽和抗体
放射疗法超出了本书的范围。然而,有多种不同的方式将放射疗法作为全身治疗引入体内。目标是以优先影响癌细胞的形式引入。
一般来说,这些放射性标记( radiolabeled)治疗与已知对辐射敏感且药物和抗体都相对容易穿透的癌症患者最为相关。这些包括血液系统癌症、前列腺癌和一些神经内分泌肿瘤。
构成治疗一部分的放射性同位素通常要么是 β 粒子发射体(如镥 - 177、钇 - 90 或钐 - 153),要么是 α 粒子发射体(如锕 - 225、镭 - 223 和钍 - 227)。
α 和 β 发射体具有对比鲜明的特性。例如,α 粒子传播距离较短,但释放更多能量。因此,α发射体造成的损害更大,它们可以在小肿瘤内递送有效剂量的辐射。β 发射体传播更远(因此可能损害肿瘤外的敏感结构),但释放的能量较少。
靶向元件通常由抗体提供,或由某种小分子提供,如受体的配体,或已知与特定靶点结合的短肽。
例如,一种称为 Lu177-PSMA-617(也称为 177Lu 标记的 PSMA-617 和镥 - 177 vipivotide tetraxetan)的前列腺癌治疗药物包括 PSMA-617,一种已知与前列腺特异性膜抗原(PSMA)结合的小分子。PSMA-617 与 β 发射放射性同位素镥-177 连接。其目的 Lu177-PSMA-617 附着在前列腺肿瘤和任何转移灶内的癌细胞上,并递送杀死细胞剂量的辐射。
放射性标记抗体(也称为放射免疫偶联物或放射免疫疗法)作为癌症治疗药物有着悠久的历史。第一个90Y-伊布替尼莫单抗-tiuxetan于 2002 年成为获批治疗药物。然而,围绕副作用、工作人员和患者安全、工作人员培训和其他实际问题的问题限制了它们的使用。
7.2 药物偶联小分子和肽
与 ADC 一样,这些包括靶向成分,这次是以肽(由氨基酸组成的短蛋白质)或小分子的形式。这与某种形式的化疗化学连接。
与ADC一样,有效治疗的关键是肽(或小分子)与药物之间可裂解连接子的设计。理想情况下,这种连接子只有在整个结构进入癌细胞时才会断裂。像肽 - 药物偶联物(PDC)这样的东西相对于ADC的一个优势是其尺寸。PDC要小得多。因此,它们可以更深入地穿透肿瘤以递送其有效载荷。
7.3 免疫毒素
这些治疗再次将靶向成分与毒性有效载荷结合。这次靶向成分与毒性蛋白融合。毒性蛋白通常是由细菌自然产生的物质,如白喉毒素。
一种成为毛细胞白血病(一种罕见白血病)获批治疗药物的免疫毒素,尽管由于使用率低现已撤回,是莫塞妥莫单抗帕苏度毒素。这种治疗包括靶向 CD22 的抗体尖端,与铜绿假单胞菌外毒素的片段融合。
另一种获得批准但后来停产的免疫毒素是地尼白介素二肽毒素,用于治疗罕见的 T 细胞淋巴瘤。这种融合蛋白将白介素-2的一部分与白喉毒素的片段结合。幸运的是,地尼白介素二肽毒素的纯化和重新配方版本于 2022 年底重新提交 FDA 批准。
仍在使用的一种免疫毒素是他格拉索夫斯普。这种治疗由白介素-3(IL-3)与缩短版本的白喉毒素融合而成。它用于治疗一种罕见的血液系统癌症,称为母细胞性浆细胞样树突状细胞肿瘤。这种癌症的细胞表面有高水平的IL-3受体。
遗憾的是,有一长串进入患者试验但未能成为获批治疗药物的免疫毒素。一些主要问题是(1)癌细胞外毒素释放引起的副作用,(2)治疗被患者的免疫系统破坏,以及(3)治疗对肿瘤的穿透性差。